Внесение изменений в регистрационное удостоверение в 2026 году: как избежать отмены регистрации медицинских изделий
- Переход к новым правилам регистрации: что меняется с 2026 года
- Риски для бизнеса: кто под угрозой отмены регистрации
- Актуализация документов УПП: почему это критично в 2026 году
- Что это означает на практике?
- Особая зона риска: «старые» доверенности до 2023 года
- Обязательная инспекция производства: второе направление подготовки
- Рекомендации: что необходимо сделать уже сейчас
- Как мы можем помочь
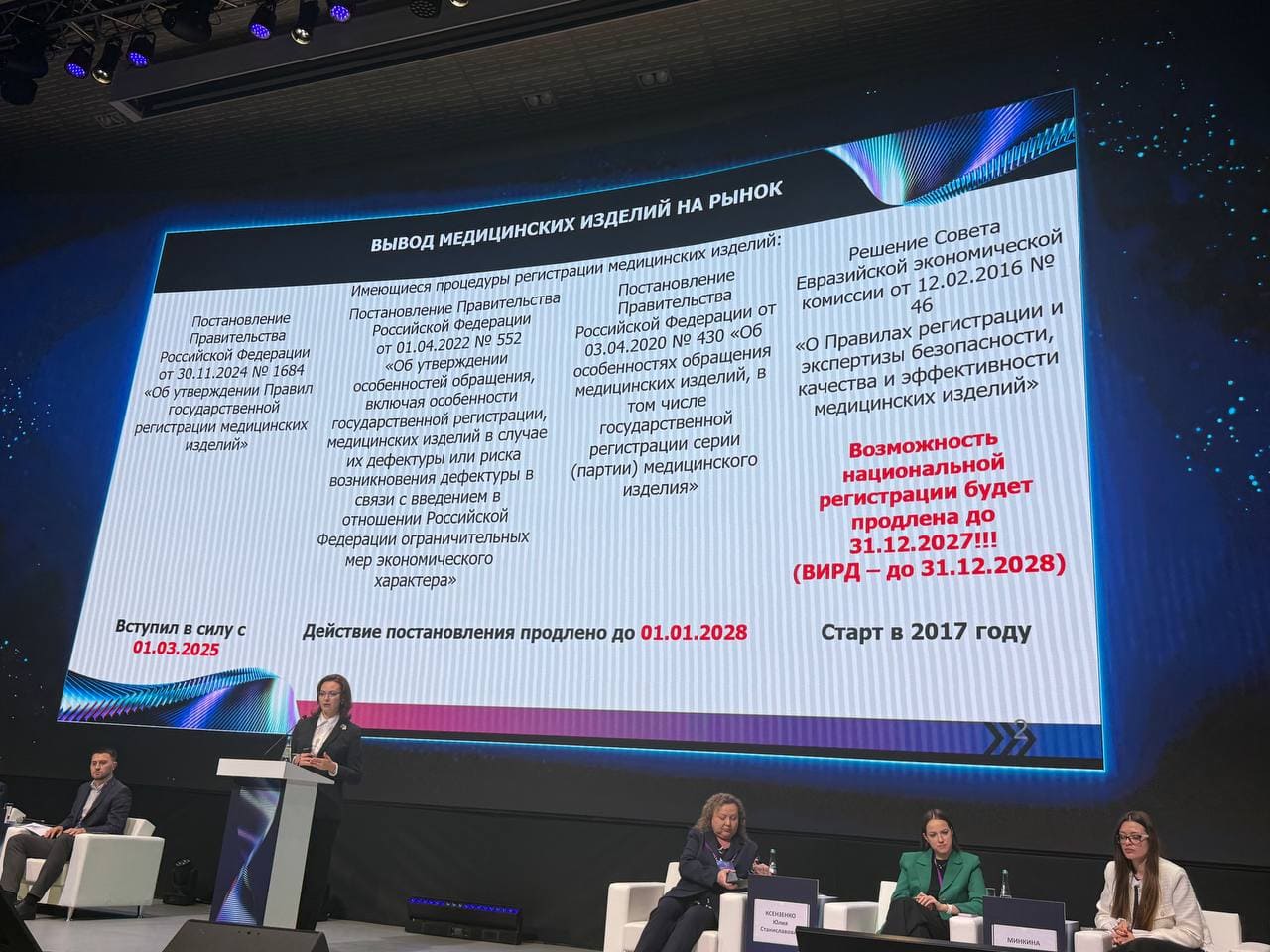
Переход к новым правилам регистрации: что меняется с 2026 года
С 1 сентября 2026 года вступают в силу ключевые положения новых Правил государственной регистрации медицинских изделий (утверждены постановлением Правительства РФ от 30.11.2024 № 1684 с изменениями). Одно из главных нововведений — ужесточение требований к актуальности сведений об уполномоченном представителе производителя (УПП). Отсутствие timely внесения изменений в регистрационное досье по этой части может стать основанием для приостановки и последующей отмены регистрации. Это напрямую затрагивает иностранных производителей, их уполномоченных представителей и владельцев «старых» регистрационных удостоверений, выданных до 2023 года.
Риски для бизнеса: кто под угрозой отмены регистрации
Изменения особенно критичны для зарубежных производителей медицинских изделий, компаний с действующими регистрационными удостоверениями старого образца и тех, кто не обновил данные об УПП. Основное основание для отмены — непредставление в срок (не позднее 90 рабочих дней) обновлённых документов, подтверждающих полномочия представителя. После 1 сентября 2026 года регулятор получит право применять жёсткие меры: от приостановки обращения изделия на рынке до полной отмены регистрации. Это приведёт к блокировке поставок, репутационным потерям и необходимости проходить полную процедуру регистрации заново.
Актуализация документов УПП: почему это критично в 2026 году
Одним из оснований для отмены государственной регистрации является отсутствие внесения изменений в регистрационное досье в части документов, подтверждающих полномочия уполномоченного представителя производителя, в срок, не превышающий 90 рабочих дней со дня окончания срока действия соответствующего документа. Большинство доверенностей на УПП оформляются на 3 года, поэтому истечение срока без обновления досье запускает цепочку санкций. В 2026 году это станет массовой причиной приостановок, особенно для изделий с «просроченными» доверенностями.
Что это означает на практике?
| Этап нарушения | Последствия для регистрации | Сроки и действия регулятора | Риски для бизнеса |
|---|---|---|---|
| Истёк срок доверенности УПП | Приостановка регистрации на 90 рабочих дней | Размещение информации на сайте Росздравнадзора | Блокировка поставок, остановка продаж |
| Не внесены изменения в досье за 90 дней | Полная отмена регистрации | Официальное уведомление и исключение из реестра | Полная потеря права обращения на рынке РФ |
| УПП ликвидирован или сменился | Основание для немедленной приостановки и отмены | Проверка реестра Росздравнадзора | Репутационные убытки, разрыв контрактов, перерегистрация |
| После 1 сентября 2026 без актуализации | Автоматическое применение санкций по подп. «е» п. 137 Правил | Массовые проверки и отмены | Критические задержки в поставках, потеря рынка |
Таблица иллюстрирует цепочку событий и подчёркивает необходимость оперативных действий уже в первой половине 2026 года.
Особая зона риска: «старые» доверенности до 2023 года
Особенно уязвимы зарубежные производители, оформившие доверенности на УПП до 2023 года, компании с сменой представителя, а также случаи ликвидации или реорганизации юридического лица-УПП. В реестре Росздравнадзора не должно оставаться «мёртвых душ» — если полномочия не подтверждены актуальными документами, это прямое основание для приостановки, а затем отмены регистрации. Рекомендуется провести аудит всех доверенностей и внести изменения до дедлайна 1 сентября 2026 года.
Обязательная инспекция производства: второе направление подготовки
Второе стратегически важное направление — инспектирование производства для изделий классов риска 2а (стерильные), 2б и 3. Все производители таких изделий обязаны пройти инспекцию. Процедура длительная и многоэтапная, очереди на проведение инспекций растут. Без действующей инспекции невозможно поддерживать регистрационный статус изделия. Ожидание до 2026 года создаёт риск одновременной перегрузки регистрирующего органа и инспекционных структур, что может привести к критическим задержкам в подтверждении изменений.
Рекомендации: что необходимо сделать уже сейчас
Производителям и уполномоченным представителям следует срочно актуализировать сведения об УПП, проанализировать необходимость внесения иных изменений в досье, подготовиться к инспекции производства и провести аудит регистрационного портфеля. Внесение изменений в регистрационное удостоверение в 2026 году требует тщательной подготовки документов и соблюдения 90-дневного срока. Это позволит избежать приостановок и сохранить доступ к российскому рынку.
Как мы можем помочь
• актуализация информации о полномочиях уполномоченного представителя,
• анализ иных изменений по представленным производителем актуальным сертификатам
• внесение изменений в регистрационное досье,
• подготовка к инспектированию производства,
• аудит регистрационного портфеля,
• внедрение системы менеджмента качества на производство.
Мы работаем как с зарубежными производителями, так и с российскими УПП.
24

