Единый реестр организаций ЕАЭС, уполномоченных проводить испытания медизделий для регистрации
Правовая база и требования к организациям
В соответствии с решением Совета ЕЭК от 12.02.2016 № 46 выполнять исследования, подтверждающие качество, безопасность и действенность товаров медицинского назначения, имеют право лишь уполномоченные организации, включенные в Единый реестр. Это, казалось бы, простое условие означает, что компания прошла проверку на соответствие действующим требованиям и подтвердила свое соответствие им.
В свою очередь, список этих требований различается в зависимости от того, каким видом деятельности собирается заниматься исследовательский центр. Так, для организаций, которые занимаются выполнением клинических и клинико-лабораторных испытаний, требования определяются решением Совета ЕЭК от 12 февраля 2016 года N 29. Согласно пункту 23 этого решения, получить право на выполнение таких исследований и, соответственно, включение в Единый реестр, имеют право компании, которые отвечают следующим условиям:
наличие действующей лицензии на выполнение медицинской деятельности в области, соответствующей назначению и области использования исследуемых медизделий;
- наличие в компании локальной нормативной документации, устанавливающей правила организации клинических и клинико-лабораторных испытаний;
- наличие условий, необходимых для качественного выполнения исследований соответствующего профиля;
- наличие в компании квалифицированного персонала, прошедшего профильную подготовку;
- наличие условий для проведения интенсивной терапии и реанимации в случае необходимости.
К исследовательским центрам, специализирующимся на проведении исследований медизделий для диагностики in vitro, предъявляются только первые два требования из перечисленных.
В свою очередь, процедура включения в реестр организаций, имеющих право выполнения технических испытаний, определена положениями решения Совета ЕЭК от 12 февраля 2016 года N 28. Согласно пункту 26 этого нормативного документа компания, претендующая на включение в реестр, должна иметь:
- собственную испытательную лабораторию или аффилированные отношения с организацией с такой лабораторией;
- действующий аттестат аккредитации в своей стране, являющейся членом ЕАЭС;
- область аккредитации, позволяющую проводить технические испытания медизделий;
- внедренную и сертифицированную систему менеджмента качества;
- внутреннее руководство по организации испытаний с обязательным соблюдением его требований;
- команду подготовленных специалистов, имеющих профильное образование необходимого уровня и не менее чем двухлетний опыт работы в сфере проведения технических испытаний или измерений, соответствующих области аккредитации.
Единый реестр
Компании, которые отвечают всем этим требованиям, имеют право обратиться в Евразийскую экономическую комиссию для подачи заявки на внесение информации об организации в Единый реестр. Согласно решению Совета Евразийской экономической комиссии от 12 февраля 2016 года N 30 реестр является частью единой системы контроля за обращением медизделий на территории ЕАЭС, а его ведением занимается сама ЕЭК.
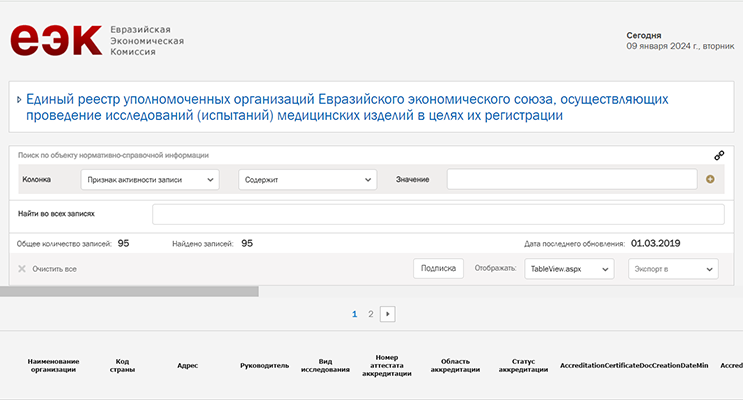
Реестр размещается на сайте ЕЭК в открытом доступе, чтобы любое заинтересованное лицо, например, производитель медицинских изделий, которому необходимо организовать проведение испытаний для государственной регистрации, могло убедиться в полномочиях своего контрагента. На текущий момент в базе зарегистрировано 95 организаций. По каждой из них в реестре в табличном виде приводится следующая информация:
- статус активности реестровой записи;
- тип организации;
- название компании;
- код страны;
- адрес учреждения;
- информация о руководителе;
- виды проводимых исследований;
- номер аттестата аккредитации, выданного в стране регистрации;
- область аккредитации;
- дата выдачи аттестата аккредитации;
- полное и краткое название хозяйствующего субъекта;
- название организационно-правовой формы;
- идентификатор налогоплательщика;
- код причины постановки на учет;
- код вида испытаний медизделий для государственной регистрации;
- техническая дата и время обновления данных в реестре;
- ключ записи подсистемы нормативно-справочной информации (ПС НСИ);
- дополнительные и служебные данные.
Перечисленные сведения представлены в краткой форме. Каждую карточку организации можно раскрыть, чтобы увидеть там дополнительные данные, полностью прочитать текст в том или ином разделе либо найти сведения в необходимых форматах – json, xml и т.д. Отметим, что большую часть списка составляют организации из России: их в базе 75, тогда как компаний из Беларуси – 13, из Кыргызстана – 5, из Казахстана – 2.
363

