Регистрация лекарственных препаратов
Регистрация лекарственного препарата РФ Регистрация включает процедуру прохождения государственной экспертизы, которая подтверждает качество, безопасность и, конечно же, действенность препарата. Только после того, как пройдена регистрация и сертификация, лекарственное средство получит разрешение на его продажу.
- Список препаратов, подлежащих учету
- Важно
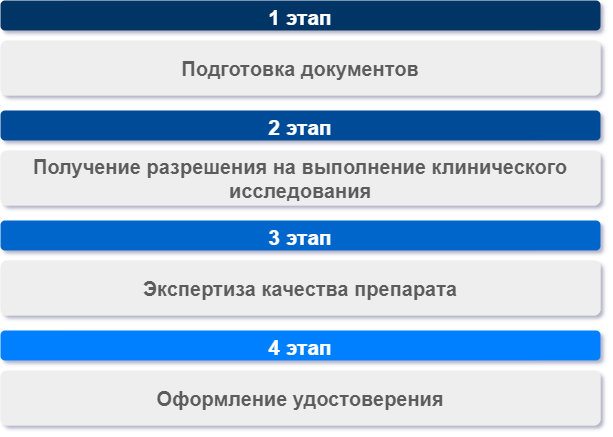
- Этапы регистрации лекарственных средств
- Нормативные документы
Список препаратов, подлежащих учету
В соответствии с законом РФ от 12.04.2010 г. № 61-ФЗ регистрация операций, связанных с обращением лекарственных средств, проводится для следующих категорий ЛП:
- все товары (оригинальные, воспроизведенные, биоаналоговые), впервые подлежащие вводу в обращение в РФ;
- новые комбинации зарегистрированных ранее ЛП;
- препараты, зарегистрированные ранее, но произведенные в других лекарственных формах, в новой дозировке.
Важно
Согласно постановлению Правительства от 3 декабря 2015 г. N 1314 все изготовители этой категории товаров должны получить заключение GMP, формируемое Минпромторгом России. В соответствии с данным постановлением ГК Аттэк осуществляет полное сопровождение процедуры на территории Российской Федерации и за рубежом.
Этапы регистрации лекарственных средств
Нормативные документы
Процедура государственной регистрации лекарственных препаратов проводится с применением следующих нормативных документов:
Приказ Минпромторга России от 14.06.2013 N 916, определяющий правила надлежащей производственной практики;
Приказ Минпромторга России от 26.05.2016 N 1714, утверждающий административный регламент министерства по оказанию госуслуги по выдаче заключений, подтверждающих соответствие изготовителей требованиям надлежащей производственной практики;
Приказ Минпромторга России от 04.02.2016 N 261, определяющий формы заявлений о предоставлении заключения, подтверждающего соответствие изготовителей требованиям надлежащей производственной практики, а также инспекционного отчета, формируемого по результатам проверки отечественного или иностранного изготовителя с точки зрения его соответствия требованиям надлежащей производственной практики;
Приказ Минпромторга России от 11.01.2016 N 9, устанавливающий порядок определения стоимости услуги по проведению инспектирования иностранных производителей лекарственных средств на соответствие требованиям надлежащей производственной практики и выдачи подтверждающих заключений, а также правила расчета максимальной стоимости такой услуги;
Приказ Минпромторга России от 12.12.2013 N 1997, определяющий перечень рекомендаций по проведению контроля качества лекарственных средств и организации их производств;
Федеральный закон № 61-ФЗ от 12.04.2010, посвященный вопросам обращения лекарственных средств;
Приказ Минздравсоцразвития РФ от 23 ноября 2011 г. N 1413н, устанавливающий методические рекомендации по подготовке и оформлению документации, входящей в состав регистрационного досье на лекарственный препарат, подаваемое в целях проведения его государственной регистрации;
Приказ от 26 августа 2010 г. N 750н, устанавливающий правила выполнения экспертизы лекарственных средств и образцы заключений, формируемых экспертной комиссией.
